A Agência Nacional de Vigilância Sanitária (Anvisa) definiu os procedimentos de submissão contínua de dados técnicos para o registro de vacinas contra a covid-19. A Instrução Normativa nº 77/2020 foi aprovada ontem (17) pela diretoria colegiada do órgão e publicada hoje (18) no Diário Oficial da União.
Segundo a Anvisa, os diretores também dispensaram a análise de impacto regulatório e consulta pública para o registro devido ao grau de urgência da vacina e gravidade da doença.
“A medida possibilitará acelerar a disponibilização à população brasileira de vacinas contra o novo coronavírus, desde que demonstradas qualidade, segurança e eficácia conforme os requerimentos técnicos e regulatórios vigentes”, informou a agência, em comunicado.
No procedimento de submissão contínua, os dados técnicos deverão ser encaminhados à Anvisa conforme forem gerados. Assim, as empresas interessadas no registro de vacinas não precisam ter em mãos todos os documentos reunidos para apresentá-los ao órgão regulador.
Submissão contínua
Esse procedimento será normatizado apenas para as vacinas contra covid-19 a serem registradas no país. Segundo a Anvisa, outras autoridades regulatórias de referência, como a dos Estados Unidos, da Europa, da Suíça e da China, já utilizam a submissão contínua em situações específicas.
A proposta da Anvisa prevê o atendimento a dois critérios para uso desse procedimento diferenciado. Um deles se refere à exigência de um dossiê de desenvolvimento clínico de medicamento referente à vacina proposta, protocolado na agência. Outro critério é que a pesquisa esteja em fase 3 de desenvolvimento clínico.
As vacinas que tiverem a análise iniciada pelo procedimento de submissão contínua poderão ser submetidas ao pedido de registro formal após a conclusão da análise do último aditamento protocolado.
Além disso, a empresa deve ter dados suficientes de qualidade, eficácia e segurança para o estabelecimento de uma relação positiva de benefício e risco da vacina, considerando a indicação terapêutica solicitada à Anvisa.
A instrução normativa publicada hoje regulamenta artigo da Resolução nº 55/2010 da Anvisa, que diz que a empresa solicitante do registro poderá procurar a Coordenação de Produtos Biológicos para discutir aspectos relacionados ao desenvolvimento do produto, antes da submissão da documentação de registro.
Deixe seu Comentário
Leia Também

Projeto de Lei cria o Dia Municipal de Adoção Animal em Corumbá
Professores da UFMS decidem por paralisação a partir de 1º de maio

Vereador cobra instalação de lixeiras na cidade com intensa campanha educativa

Com mais 1 morte confirmada, MS já tem 15 vítimas da dengue

Morte de cão extraviado faz Gol suspender transporte de animais

Anvisa publica resolução que proíbe cigarro eletrônico no Brasil
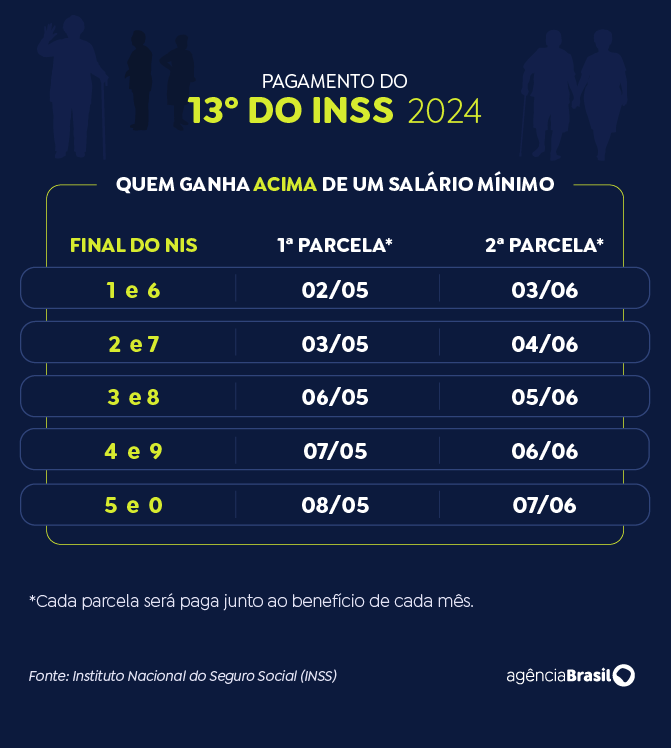
Beneficiários do INSS começam a receber o 13º a partir desta quarta-feira (24)

Lajotas retiradas da rua Ladário serão reaproveitadas em alamedas e vias de menor movimento

Vereador pede agilidade nas cirurgias ginecológicas para reduzir fila de espera em Corumbá



 Norma foi publicada no Diário Oficial da União de hoje. (Divulgação)
Norma foi publicada no Diário Oficial da União de hoje. (Divulgação)


